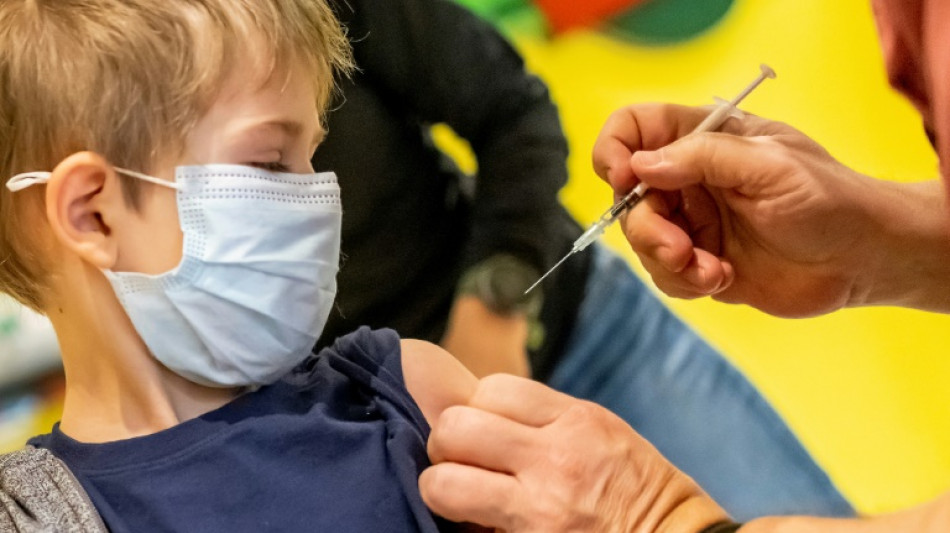

Décision américaine repoussée sur le vaccin anti-Covid pour les moins de 5 ans
Les autorités sanitaires américaines ont annoncé vendredi repousser leurs délibérations sur l'autorisation en urgence du vaccin anti-Covid de Pfizer pour les enfants de six mois à 4 ans, afin d'attendre des données plus complètes sur trois doses.
Cette décision devrait reporter de plusieurs semaines au moins l'autorisation potentielle d'un premier vaccin pour cette tranche d'âge, qui comprend 18 millions d'enfants aux Etats-Unis.
Une réunion d'un comité d'experts avait été convoquée pour mardi prochain, mais celui-ci devait se prononcer sur l'autorisation de deux doses seulement.
Dans ce cadre, Pfizer avait transmis les premiers résultats de ses essais cliniques à l'Agence américaine des médicaments (FDA).
"Les données que nous avons vues nous ont fait réaliser que nous avions besoin de voir des données sur la troisième dose", a déclaré lors d'une conférence de presse Peter Marks, responsable au sein de la FDA.
L'agence américaine a ainsi annoncé "repousser" la réunion.
L'alliance Pfizer-BioNTech a également déclaré dans un communiqué avoir décidé "d'attendre les données sur trois doses", ce nombre étant susceptible de fournir "un plus haut niveau de protection pour ce groupe d'âge".
Ces données devraient être disponibles "début avril", ont précisé les entreprises.
Pour ces très jeunes enfants, une dose de seulement 3 microgrammes par piqûre a été choisie par le géant pharmaceutique (contre 30 pour les adultes, et 10 pour les 5-11 ans), afin de limiter les effets secondaires.
Mais avec cette dose réduite, la réponse immunitaire provoquée chez les 2 à 4 ans s'est révélée moins forte qu'espéré, avait fait savoir Pfizer en décembre.
L'entreprise avait ainsi annoncé vouloir tester une troisième dose de vaccin pour cette tranche d'âge, et avait amendé le protocole de ses essais cliniques en ce sens.
Mais à la surprise générale, Pfizer avait annoncé au début du mois avoir demandé l'autorisation en urgence de son vaccin pour une série de deux doses, tout en précisant qu'elle devrait au total en comporter trois.
L'entreprise avait dit l'avoir fait sur demande de la FDA.
L'idée des responsables américains était de gagner du temps, et que les parents puissent commencer les deux premières injections, en attendant l'autorisation potentielle de la troisième, qui doit être injectée au moins deux mois après la deuxième.
Mais certains experts avaient ouvertement critiqué cette démarche hautement inhabituelle.
La décision de vendredi devrait ainsi être largement interprétée comme un revers pour la stratégie des autorités.
M.P.Huber--MP